Глюкагонът е пептиден хормон, произведен от алфа клетки на панкреаса. Глюкагонът повишава концентрацията на глюкоза и мастни киселини в кръвта и се счита за основния катаболен хормон на тялото. Глюкагонът се използва и като лекарство за лечение на редица здравословни състояния. Ефектът на глюкагона е противоположен на този на инсулина, който понижава извънклетъчната глюкоза. Глюкагонът се произвежда от проглюкагон, кодиран от гена GCG.
Панкреасът освобождава глюкагон, когато количеството глюкоза в кръвта е твърде ниско. Глюкагонът кара черния дроб да участва в гликогенолиза: превръща съхранявания гликоген в глюкоза, която се освобождава в кръвта. Високите нива на глюкоза в кръвта, от друга страна, стимулират отделянето на инсулин. Инсулинът позволява усвояването и използването на глюкоза от инсулинозависимите тъкани. По този начин глюкагонът и инсулинът са част от система за обратна връзка, която поддържа нивата на кръвната захар стабилни. Глюкагонът увеличава енергийните разходи и е повишен при условия на стрес. Глюкагонът принадлежи към семейството на хормоните на секретините.
Функция на глюкагон
Глюкагонът обикновено повишава концентрацията на глюкоза в кръвта чрез насърчаване на глюконеогенезата и гликогенолизата. Глюкагонът също така намалява синтеза на мастни киселини в мастната тъкан и черния дроб. Глюкагонът насърчава липолизата в тези тъкани, което ги кара да освобождават мастни киселини в циркулацията, където те могат да се катаболизират, за да генерират енергия в тъкани като скелетни мускули, когато е необходимо.
Глюкозата се съхранява в черния дроб под формата на полизахарид гликоген, който е глюкан (полимер, съставен от молекули глюкоза). Чернодробните клетки (хепатоцити) имат глюкагонови рецептори. Когато глюкагонът се свърже с глюкагоновите рецептори, чернодробните клетки преобразуват гликогена в отделни глюкозни молекули и ги освобождават в кръвния поток, в процес, известен като гликогенолиза. Когато съхранението на глюкоза се изчерпи, глюкагонът насърчава черния дроб и бъбреците да синтезират допълнителна глюкоза чрез глюконеогенеза. Глюкагонът изключва гликолизата в черния дроб, в резултат на което гликолитичните междинни продукти се транспортират до глюконеогенеза.
Глюкагонът също регулира скоростта на производство на глюкоза чрез липолиза. Глюкагонът предизвиква липолиза при хора в условия на инсулинова супресия (като захарен диабет тип 1).
Изглежда, че производството на глюкагон зависи от централната нервна система чрез пътища, които тепърва ще бъдат определени. Съобщава се, че при безгръбначни животни отстраняването на очни очи влияе върху производството на глюкагон. Изрязването на очната глава при млади раци води до индуцирана от глюкагон хипергликемия.
Механизъм на действие на глюкагона
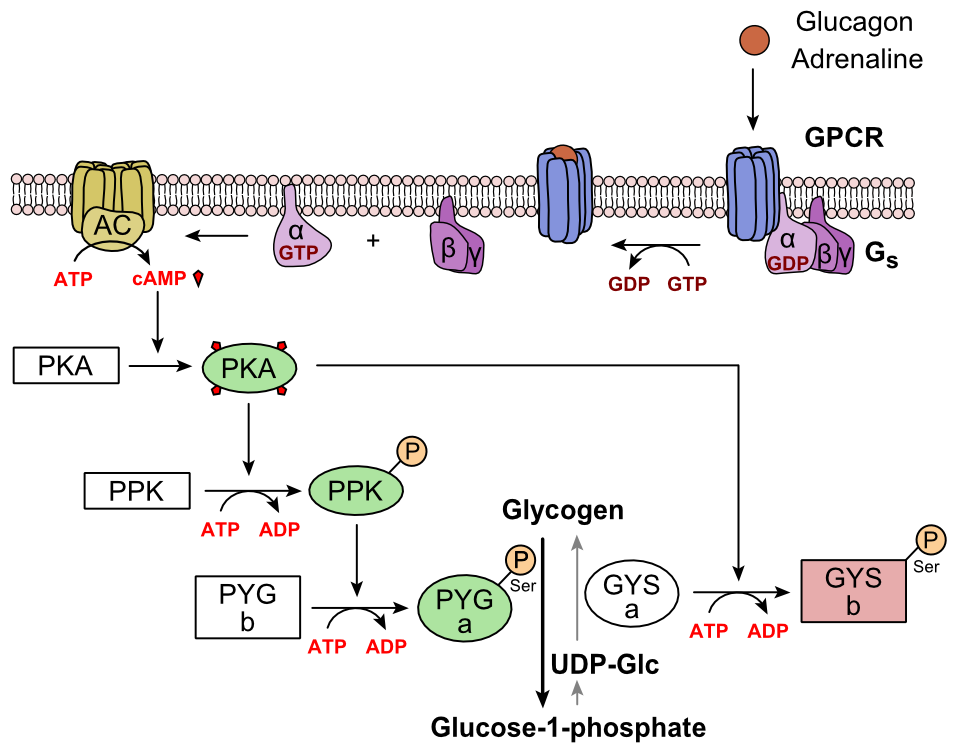
Глюкагонът се свързва с глюкагоновия рецептор, G-свързан рецептор, разположен в плазмената мембрана на клетката. Промяната на конформацията в рецептора активира G протеини, хетеротримерен протеин с α, β и γ субединици. Когато G протеинът взаимодейства с рецептора, той претърпява конформационна промяна, която води до заместване на молекулата GDP, която е свързана с α субединицата с GTP молекула. Това заместване води до освобождаване на α субединицата от β и γ субединиците. Алфа субединицата конкретно активира следващия ензим в каскадата, аденилат циклаза.
Аденилатциклазата произвежда цикличен аденозин монофосфат (цикличен AMP или cAMP), който активира протеин киназа А (cAMP-зависима протеин киназа). Този ензим от своя страна активира фосфорилаза киназа, която след това фосфорилира гликоген фосфорилаза b (PYG b), превръщайки я в активната форма, наречена фосфорилаза а (PYG a). Фосфорилазата а е ензимът, отговорен за освобождаването на глюкоза 1-фосфат от гликогенните полимери.
Пример за това може да бъде, когато глюкагонът се свързва с трансмембранен протеин. Трансмембранните протеини взаимодействат с Gɑβ𝛾. Gɑ се отделя от Gβ𝛾 и взаимодейства с трансмембранния протеин аденилил циклаза. Аденилил циклазата катализира превръщането на АТФ в сАМР. cAMP се свързва с протеин киназа А, а комплексът фосфорилира фосфорилаза киназа. Фосфорилирана фосфорилаза киназа фосфорилира фосфорилаза. Фосфорилираната фосфорилаза изрязва глюкозните единици от гликоген като глюкозен 1-фосфат.
Освен това координираният контрол на гликолизата и глюконеогенезата в черния дроб се регулира от състоянието на фосфорилиране на ензимите, които катализират образуването на мощен активатор на гликолиза, наречен фруктоза 2,6-бисфосфат. Ензимната протеин киназа А (PKA), която се стимулира от каскадата, инициирана от глюкагон, също ще фосфорилира единичен серинов остатък от бифункционалната полипептидна верига, съдържаща както ензимите фруктоза 2,6-бисфосфатаза, така и фосфофруктокиназа-2. Това ковалентно фосфорилиране, инициирано от глюкагон, активира първото и инхибира второто. Това регулира реакцията, катализираща фруктоза 2,6-бисфосфат (мощен активатор на фосфофруктокиназа-1, ензимът, който е основният регулаторен етап на гликолизата), като забавя скоростта на нейното образуване, като по този начин инхибира потока на гликолизния път и позволява глюконеогенезата да преобладава. Този процес е обратим при липса на глюкагон (и по този начин, наличието на инсулин).
Глюкагоновата стимулация на PKA също деактивира гликолитичния ензим пируват киназа в хепатоцитите.
Физиология
Производство на глюкагон
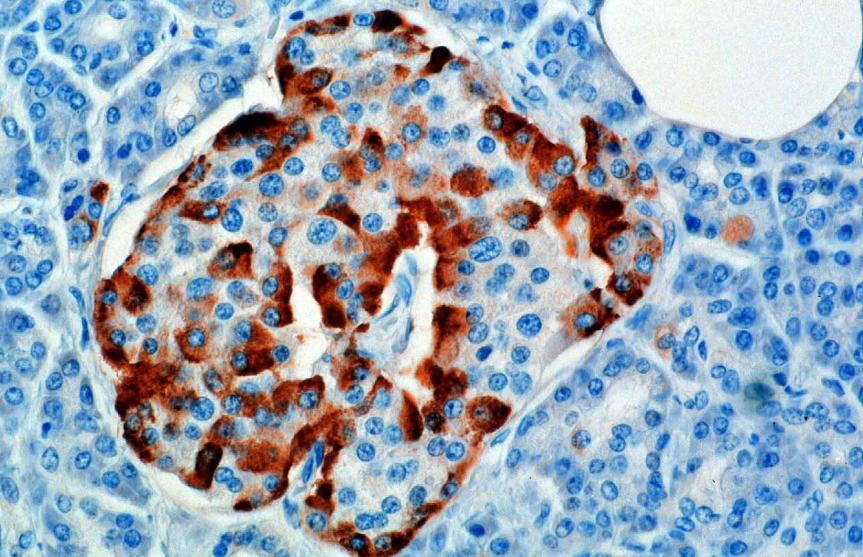
Хормонът се синтезира и секретира от алфа клетки (α-клетки) на островчетата Лангерханс, които се намират в ендокринната част на панкреаса. Производството, което иначе протича свободно, се потиска / регулира от амилин, пептиден хормон, ко-секретиращ се с инсулин от β клетките на панкреаса. Тъй като нивата на глюкозата в плазмата намаляват, последващото намаляване на секрецията на амилин облекчава нейното потискане на α клетките, позволявайки секрецията на глюкагон.
При гризачите алфа клетките са разположени във външния ръб на островчето. Структурата на човешките островчета е много по-малко сегрегирана и алфа клетките се разпределят по целия остров в непосредствена близост до бета клетките. Глюкагонът се произвежда и от алфа клетки в стомаха.
Последните изследвания показват, че производството на глюкагон може да се осъществи и извън панкреаса, като червата са най-вероятното място за синтез на извънпанкреатичен глюкагон.
Регулиране на глюкагона
Секрецията на глюкагон се стимулира от:
- Хипогликемия
- Епинефрин (чрез β2, α2 и α1 адренергични рецептори)
- Аргинин
- Аланин (често от мускулно получено пируват / глутамат трансаминиране
- Ацетилхолин
- Холецистокинин
- Стомашен инхибиторен полипептид
Секрецията на глюкагон се инхибира от:
- Соматостатин
- Амилин
- Инсулин (чрез GABA)
- PPARγ / хетеродимер на ретиноиден X рецептор.
- Повишени свободни мастни киселини и кетокиселини в кръвта.
- Повишено производство на карбамид
- Подобен на глюкагон пептид-1
Структура на глюкагона
Глюкагонът е 29-аминокиселинен полипептид. Основната му структура при хората е: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp -Leu-Met-Asn-Thr-COOH.
Полипептидът има молекулна маса от 3485 далтона. Глюкагонът е пептиден (нестероиден) хормон.
Глюкагонът се генерира от разцепването на проглукагон от пропротеин конвертаза 2 в а-клетки на панкреатични островчета. В чревните L клетки, пролукагонът се разцепва до алтернативните продукти глицентин, GLP-1 (инкретин), IP-2 и GLP-2 (насърчава чревния растеж).
Патология
Ненормално повишени нива на глюкагон могат да бъдат причинени от тумори на панкреаса, като глюкагоном, симптомите на които включват некролитичен мигриращ еритем, намалени аминокиселини и хипергликемия. Може да се появи самостоятелно или в контекста на множествена ендокринна неоплазия тип 1.
Повишеният глюкагон допринася основно за хипергликемичната кетоацидоза при недиагностициран или лошо лекуван диабет тип 1. Тъй като бета клетките престават да функционират, инсулинът и GABA на панкреаса вече не присъстват, за да потиснат освобождаването на глюкагон. В резултат на това глюкагонът се освобождава от алфа клетките максимум, причинявайки бързо разграждане на гликогена до глюкоза и бърза кетогенеза. Установено е, че подгрупа възрастни с диабет тип 1 отнема средно 4 пъти повече, за да се доближи до кетоацидоза, когато се дава соматостатин (инхибира производството на глюкагон) без инсулин. Инхибирането на глюкагона е популярна идея за лечение на диабет, но някои предупреждават, че това ще доведе до чуплив диабет при пациенти с адекватно стабилна кръвна глюкоза.
Липсата на алфа клетки (а оттам и на глюкагон) се смята за едно от основните влияния в екстремната променливост на кръвната глюкоза в условията на пълна панкреатектомия.
История
През 20-те години Кимбъл и Мърлин изучават екстракти на панкреаса и откриват допълнително вещество с хипергликемични свойства. Те описват глюкагон през 1923 г. Аминокиселинната последователност на глюкагона е описана в края на 50-те години. По-пълно разбиране за ролята му във физиологията и заболяванията е установено едва през 70-те години, когато е разработен специфичен радиоимунологичен анализ.
.














Discussion about this post