| Алфа-амилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
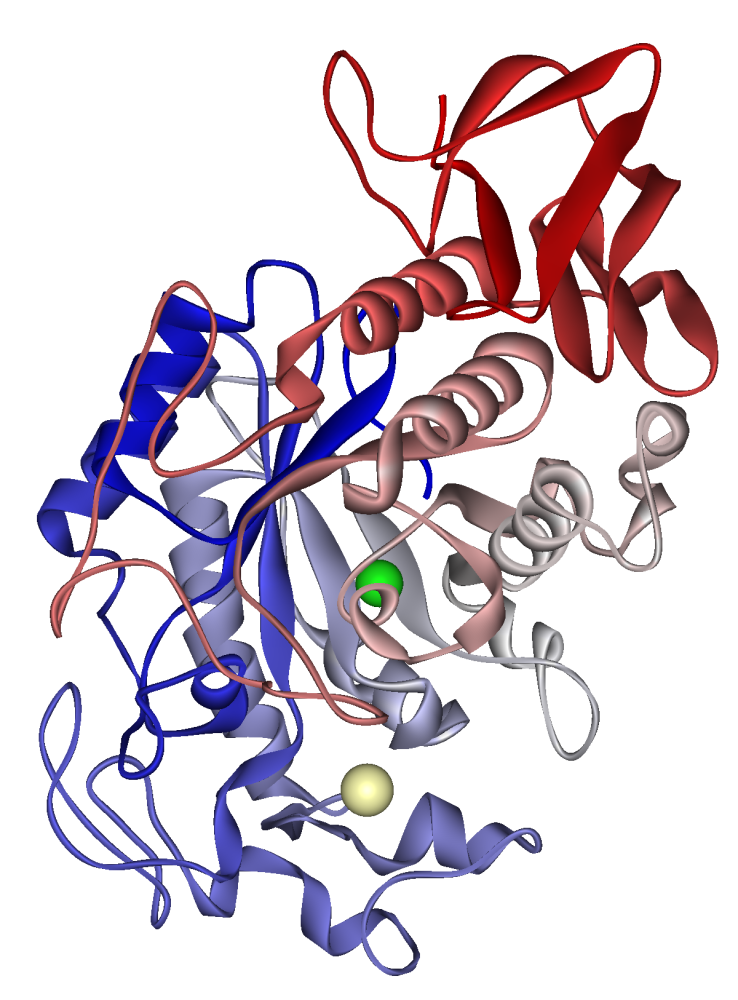
Човешка слюнна амилаза: калциев йон, видим в бледо каки, хлориден йон в зелено. PDB 1SMD
|
|||||||||
| Идентификатори | |||||||||
| № на ЕО | 3.2.1.0 | ||||||||
| CAS номер | 9000-90-2 | ||||||||
| Бази данни | |||||||||
| IntEnz | Изглед IntEnz | ||||||||
| БРЕНДА | БРЕНДА влизане | ||||||||
| ExPASy | Изглед на NiceZyme | ||||||||
| KEGG | Влизане в KEGG | ||||||||
| MetaCyc | метаболитен път | ||||||||
| ПРИАМ | профил | ||||||||
| PDB структури | RCSB PDB PDBe PDBсума | ||||||||
|
|||||||||
| GH13 каталитичен домен | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Циклодекстрин глюканотрансфераза (ec2.4.1.19) (cgtase)
|
|||||||||
| Идентификатори | |||||||||
| Символ | Алфа-амилаза | ||||||||
| Pfam | PF00128 | ||||||||
| Клан Pfam | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM суперсемейство | 117 | ||||||||
| OPM протеин | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Алфа-амилаза С-краен домейн на бета-лист | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Кристална структура на ечемичен алфа-амилазен изозим 1 (amy1) неактивен мутант d180a в комплекс с малтохептаоза
|
|||||||||
| Идентификатори | |||||||||
| Символ | Алфа-амил_С2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Алфа амилаза, С-краен изцяло бета домейн | |||||||||
|---|---|---|---|---|---|---|---|---|---|
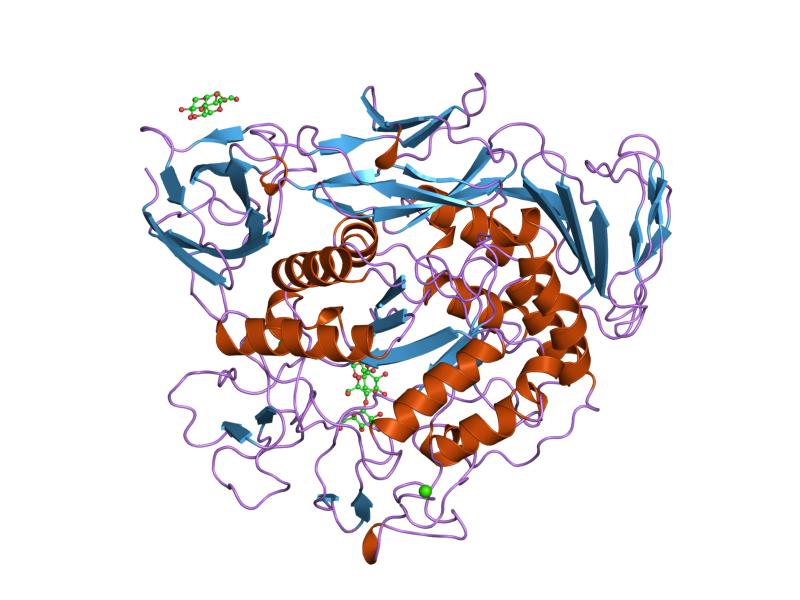
малтотриозен комплекс от предварително кондициониран мутант на циклодекстрин гликозилтрансфераза
|
|||||||||
| Идентификатори | |||||||||
| Символ | Алфа-амилаза_С | ||||||||
| Pfam | PF02806 | ||||||||
| Клан Pfam | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Алфа-амилаза, (α-амилаза) е ензим ЕС 3.2.1.1, който хидролизира алфа връзките на големи, свързани с алфа полизахариди, като нишесте и гликоген, като дава по-къси вериги от тях, декстрини и малтоза. Това е основната форма на амилаза, открита при хора и други бозайници. Той присъства и в семената, съдържащи нишесте като хранителен резерв, и се секретира от много гъби. Той е член на семейство гликозид хидролаза 13.
В човешката биология
Въпреки че се намира в много тъкани, амилазата е най-изявена в панкреатичния сок и слюнката, всяка от които има своя собствена изоформа на човешка α-амилаза. Те се държат по различен начин при изоелектричното фокусиране и могат да бъдат разделени при тестване чрез използване на специфични моноклонални антитела. При хората всички амилазни изоформи се свързват с хромозома 1p21 (вж. AMY1A).
Слюнчена амилаза (ptyalin)
Амилазата се намира в слюнката и разгражда нишестето до малтоза и декстрин. Тази форма на амилаза се нарича още „ptyalin“ /ˈTaɪəlɪн/, която е кръстена от шведския химик Йонс Якоб Берцелиус. Името произлиза от гръцката дума πτυω (плюя), тъй като веществото е получено от слюнка. Той ще разбие големи, неразтворими молекули на нишестето на разтворими нишестета (амилодекстрин, еритродекстрин и ахродекстрин), произвеждайки последователно по-малки нишестета и в крайна сметка малтоза. Птиалинът действа върху линейни α (1,4) гликозидни връзки, но хидролизата на съединенията изисква ензим, който действа върху разклонени продукти. Слюнчената амилаза се инактивира в стомаха от стомашната киселина. В стомашния сок, коригиран до рН 3,3, ptyalin е напълно инактивиран за 20 минути при 37 ° C. За разлика от това, 50% от активността на амилазата остава след 150 минути излагане на стомашен сок при рН 4.3. Както нишестето, субстратът за птиалин, така и продуктът (къси вериги глюкоза) са в състояние частично да го предпазят от инактивиране от стомашната киселина. Птиалинът, добавен към буфера при рН 3.0, претърпя пълно инактивиране за 120 минути; добавянето на нишесте при ниво от 0,1% обаче води до 10% от оставащата активност, а подобно добавяне на нишесте до ниво от 1,0% води до около 40% от активността, оставащо след 120 минути.
Оптимални условия за ptyalin
- Оптимално рН – 7,0
- Температура на човешкото тяло
- Наличие на определени аниони и активатори:
- Хлорид и бромид – най-ефективни
- Йодид – по-малко ефективен
- Сулфат и фосфат – най-малко ефективни
Генетични вариации в човешката слюнна амилаза
Генът на слюнчената амилаза е претърпял дублиране по време на еволюцията и изследванията на ДНК хибридизацията показват, че много индивиди имат множество тандемни повторения на гена. Броят на генните копия корелира с нивата на слюнчената амилаза, измерена чрез анализи на протеинови блотове, използващи антитела към човешка амилаза. Номерът на генното копие се свързва с очевидното еволюционно излагане на диети с високо съдържание на нишесте. Например, японски индивид е имал 14 копия на гена на амилаза (един алел с 10 копия и втори алел с четири копия). Японската диета традиционно съдържа големи количества оризово нишесте. За разлика от това, човек от Биака носеше шест копия (три копия на всеки алел). Биака са ловци-събирачи на тропически гори, които традиционно консумират диета с ниско съдържание на нишесте. Пери и колеги предполагат, че увеличеният брой копия на гена на слюнчената амилаза може да има подобрена преживяемост, съвпадаща с преминаване към нишестена диета по време на човешката еволюция.
Амилаза на панкреаса
Панкреатичната α-амилаза произволно разцепва α (1-4) гликозидните връзки на амилозата, за да даде декстрин, малтоза или малтотриоза. Той приема механизъм за двойно изместване със задържане на аномерна конфигурация. При хората слюнчената амилаза еволюира от нейно копие.
При патология
Тестът за амилаза е по-лесен за извършване от този за липаза, което го прави основният тест, използван за откриване и наблюдение на панкреатит. Медицинските лаборатории обикновено измерват или панкреатична амилаза, или обща амилаза. Ако се измерва само амилаза на панкреаса, увеличение няма да се отбележи при заушка или друга травма на слюнчените жлези.
Въпреки това, поради наличното малко количество, времето е критично при вземане на проби от кръв за това измерване. Кръвта трябва да се вземе скоро след пристъп на болка при панкреатит, в противен случай тя се екскретира бързо през бъбреците.
Слюнчената α-амилаза се използва като биомаркер за стрес и като сурогатен маркер на активността на симпатиковата нервна система (SNS), която не изисква вземане на кръв.
Интерпретация
Повишени плазмени нива при хора се откриват при:
- Травма на слюнка (включително анестетична интубация)
- Заушка – поради възпаление на слюнчените жлези
- Панкреатит – поради увреждане на клетките, които произвеждат амилаза
- Бъбречна недостатъчност – поради намалена екскреция
Общите показания на амилаза над 10 пъти горната граница на нормата (ULN) предполагат панкреатит. Пет до 10 пъти горната граница на нормата може да показва заболяване на илеус или дванадесетопръстника или бъбречна недостатъчност, а по-ниски нива обикновено се срещат при заболявания на слюнчените жлези.
Гени
- слюнка – AMY1A, AMY1B, AMY1C
- панкреас – AMY2A, AMY2B
В зърно
Активността на α-амилазата в зърното се измерва, например, чрез падащото число на Хагберг – Пертен, тест за оценка на уврежданията от кълнове или метода Phadebas. Среща се в пшеницата.
Промишлена употреба
α-амилазата се използва в производството на етанол за разбиване на нишестета в зърната във ферментиращи захари.
Първата стъпка в производството на царевичен сироп с високо съдържание на фруктоза е обработката на царевично нишесте с α-амилаза, произвеждайки по-къси вериги от захари олигозахариди.
А-амилаза, наречена „Термамил“, произхождаща от Bacillus licheniformis, се използва и в някои препарати, особено препарати за миене на съдове и нишесте.
Вижте амилаза за повече употреби на семейството амилаза като цяло.
Потенциал за медицинска употреба
α-амилазата показва ефективност при разграждане на полимикробни бактериални биофилми чрез хидролизиране на α (1-4) гликозидните връзки в структурните матрични екзополизахариди на извънклетъчното полимерно вещество (EPS).
Инхибиране на буфера
Съобщава се, че трис молекулата инхибира редица бактериални α-амилази, така че те не трябва да се използват в трис буфера.
Решителност
Налични са няколко метода за определяне на активността на а-амилазата и различните индустрии са склонни да разчитат на различни методи. Тестът за нишесте с йод, разработка на йодния тест, се основава на промяна на цвета, тъй като а-амилазата разгражда нишестето и се използва често в много приложения. Подобен, но индустриално произведен тест е тестът за амилаза Phadebas, който се използва като качествен и количествен тест в много индустрии, като детергенти, различни храни от брашно, зърно и малц и съдебна биология.
Архитектура на домейн
α-амилазите съдържат редица различни протеинови домейни. Каталитичният домен има структура, състояща се от осемверижен алфа / бета барел, който съдържа активното място, прекъснато от ~ 70-аминокиселинен свързващ калций домен, изпъкнал между бета верига 3 и алфа спирала 3, и карбоксилен терминален гръцки ключов бета-барел домейн. Няколко алфа-амилази съдържат домейн на бета-лист, обикновено в края на С. Този домейн е организиран като петверижен антипаралелен бета-лист. Няколко алфа-амилази съдържат изцяло бета домен, обикновено в края на С.
.














Discussion about this post