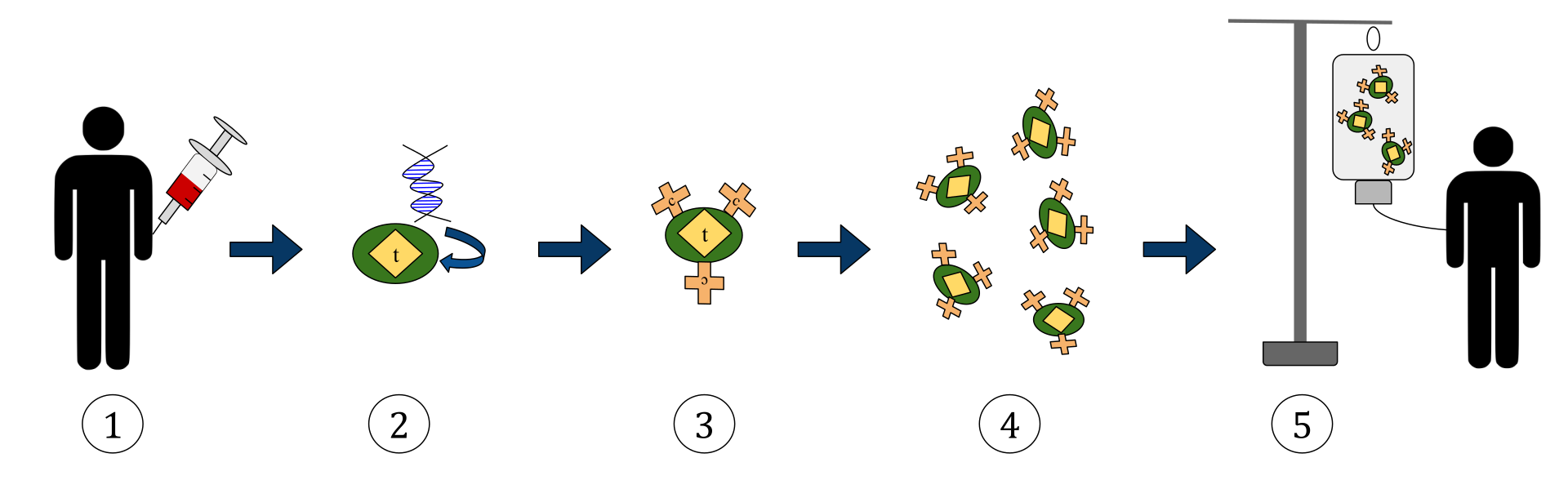
Диаграмата по-горе представя процеса на химерна антигенна рецепторна Т-клетъчна терапия (CAR). Това е метод на имунотерапия, който е нарастваща практика при лечението на рак. Крайният резултат трябва да бъде производството на оборудвани Т-клетки, които могат да разпознават и да се борят със заразените ракови клетки в тялото.
1. Т-клетките (представени от предмети, обозначени като „t“) се отстраняват от кръвта на пациента.
2. След това в лаборатория в Т-клетките се включва ген, който кодира специфичните антигенни рецептори.
3. По този начин се произвеждат CAR рецептори (обозначени като c) на повърхността на клетките.
4. Наскоро модифицираните Т-клетки след това се събират и отглеждат в лабораторията.
5. След определен период от време, инженерните Т-клетки се вливат обратно в пациента.
Т-клетки на химерен антигенен рецептор (също известен като CAR Т клетки) са Т клетки, които са генетично конструирани да произвеждат изкуствен Т-клетъчен рецептор за използване в имунотерапията.
Химерни антигенни рецептори (АВТОМОБИЛИ, също известен като химерни имунорецептори, химерни Т-клетъчни рецептори, или изкуствени Т-клетъчни рецептори) са рецепторни протеини, които са проектирани да дадат на Т клетките новата способност да се насочват към специфичен протеин. Рецепторите са химерни, защото съчетават както антиген-свързващи, така и активиращи Т-клетки функции в един рецептор.
CAR-T клетъчната терапия използва Т клетки, проектирани с CARs за терапия на рак. Предпоставката на CAR-T имунотерапията е да модифицира Т клетките, за да разпознава раковите клетки, за да ги насочи по-ефективно и да ги унищожи. Учените събират Т-клетки от хората, генетично ги променят, след което вливат получените CAR-T клетки в пациентите, за да атакуват техните тумори. CAR-T клетките могат да бъдат получени от Т клетки в собствената кръв на пациента (автоложни) или получени от Т клетките на друг здрав донор (алогенни). Веднъж изолирани от човек, тези Т клетки са генетично конструирани да експресират специфичен CAR, който ги програмира да насочват към антиген, който присъства на повърхността на туморите. За безопасност, CAR-T клетките са проектирани да бъдат специфични за антиген, експресиран върху тумор, който не се експресира върху здрави клетки.
След като CAR-T клетките се влият в пациент, те действат като „живо лекарство“ срещу раковите клетки. Когато влязат в контакт с целевия си антиген върху клетка, CAR-T клетките се свързват с нея и се активират, след което продължават да се размножават и стават цитотоксични. CAR-T клетките унищожават клетките чрез няколко механизма, включително екстензивна стимулирана клетъчна пролиферация, увеличавайки степента, до която те са токсични за други живи клетки (цитотоксичност) и като причиняват повишената секреция на фактори, които могат да повлияят на други клетки като цитокини, интерлевкини и фактори на растежа.
Производство на CAR-T клетки

Първата стъпка в производството на CAR-T клетки е изолирането на Т клетки от човешката кръв. CAR-T клетките могат да бъдат произведени или от собствената кръв на пациента, известна като автоложно лечение, или от кръвта на здрав донор, известна като алогенно лечение. Производственият процес е еднакъв и в двата случая; само изборът на първоначален донор на кръв е различен.
Първо, левкоцитите се изолират с помощта на сепаратор на кръвни клетки в процес, известен като афереза на левкоцитите. След това се отделят и събират мононуклеарни клетки от периферна кръв (PBMC). След това продуктите от аферезата на левкоцитите се прехвърлят в център за обработка на клетки. В центъра за обработка на клетки се стимулират специфични Т клетки, така че те активно да се размножават и разширяват до голям брой. За да стимулират тяхното разширяване, Т клетките обикновено се третират с цитокин интерлевкин 2 (IL-2) и анти-CD3 антитела.
Разширените Т клетки се пречистват и след това се трансдуцират с ген, кодиращ конструирания CAR чрез ретровирусен вектор, обикновено или интегриращ гамаретровирус (RV), или лентивирусен (LV) вектор. Тези вектори са много безопасни в днешно време поради частично заличаване на U3 региона. Новият инструмент за редактиране на гени CRISPR / Cas9 наскоро се използва вместо ретровирусни вектори за интегриране на гена CAR в специфични места в генома.
Пациентът се подлага на лимфоразграждане химиотерапия преди въвеждането на конструираните CAR-T клетки. Изчерпването на броя на циркулиращите левкоцити в пациента увеличава броя на произвежданите цитокини и намалява конкуренцията за ресурси, което помага да се насърчи разширяването на конструираните CAR-T клетки.
Клинични приложения
Към март 2019 г. има около 364 текущи клинични изпитвания, провеждащи се в световен мащаб, включващи CAR-T клетки. По-голямата част от тези проучвания са насочени към рак на кръвта: терапиите CAR-T представляват повече от половината от всички проучвания за хематологични злокачествени заболявания. CD19 продължава да бъде най-популярната антигенна цел, последвана от BCMA (често се изразява в мултиплен миелом). През 2016 г. проучванията започнаха да изследват жизнеспособността на други антигени, като CD20. Опитите за солидни тумори са по-малко доминирани от CAR-T, като около половината от опитите, базирани на клетъчна терапия, включват други платформи като NK клетки.
Рак
Т-клетките са генетично конструирани да експресират химерни антигенни рецептори, специално насочени към антигени върху туморните клетки на пациента, след което се вливат в пациента, където те атакуват и убиват раковите клетки. CAR-модифицираните Т-клетки могат да бъдат проектирани да насочват практически всеки тумор-свързан антиген.
Ранните изследвания на CAR-T клетки са фокусирани върху рака на кръвта. Първите одобрени лечения използват CARs, насочени към антигена CD19, присъстващ при рак, получен от В-клетки, като остра лимфобластна левкемия (ALL) и дифузен голям В-клетъчен лимфом (DLBCL). Също така се полагат усилия за инженерни CARS, насочени към много други антигени на рак на кръвта, включително CD30 в рефрактерния лимфом на Ходжкин; CD33, CD123 и FLT3 при остра миелоидна левкемия (AML); и BCMA при множествен миелом.
Солидните тумори представляват по-трудна цел. Идентифицирането на добри антигени е предизвикателство: такива антигени трябва да бъдат силно изразени в повечето ракови клетки, но до голяма степен липсват в нормалните тъкани. CAR-T клетките също не се пренасят ефективно в центъра на солидни туморни маси, а враждебната туморна микросреда потиска активността на Т клетките.
Автоимунно заболяване
Докато повечето CAR T-клетъчни изследвания се фокусират върху създаването на CAR T-клетка, която може да унищожи определена клетъчна популация (например CAR T-клетки, насочени към лимфомни клетки), има и други потенциални приложения за тази технология. Т-клетките също могат да защитят собствените антигени от автоимунни реакции. Регулаторна Т-клетка, оборудвана с CAR, може да има потенциал да придаде толерантност към специфичен антиген, нещо, което може да бъде използвано при трансплантация на органи или ревматични заболявания като лупус.
Satefy
Има сериозни странични ефекти, които са резултат от въвеждането на CAR-T клетки в тялото, включително синдром на освобождаване на цитокини и неврологична токсичност. Тъй като това е относително ново лечение, има малко данни за дългосрочните ефекти на CAR-T клетъчната терапия. Все още има опасения относно дългосрочната преживяемост на пациентите, както и усложненията на бременността при пациенти, лекувани с CAR-T клетки. Анафилаксията е очакван страничен ефект, тъй като CAR се прави с чуждо моноклонално антитяло и в резултат провокира имунен отговор.
Разпознаването на прицел / извън тумора се случва, когато CAR-T клетката разпознае правилния антиген, но антигенът се експресира върху здрава непатогенна тъкан. Това води до това, че CAR-T клетките атакуват нетуморната тъкан, като здрави В клетки, които експресират CD19. Тежестта на този неблагоприятен ефект може да варира от аплазия на В-клетките, която може да се лекува с поддържащи инфузии, до екстремна токсичност, водеща до смърт.
Съществува също така малката вероятност конструираните CAR-T клетки сами да се трансформират в ракови клетки чрез инсерционна мутагенеза, поради вирусния вектор, който вкарва CAR гена в туморен супресор или онкоген в генома на Т-клетката гостоприемник. Някои ретровирусни (RV) вектори носят по-малък риск от лентивирусните (LV) вектори. И двете обаче имат потенциал да бъдат онкогенни. Анализът на геномно секвениране на местата за въвеждане на CAR в Т клетки е установен за по-добро разбиране на функцията и устойчивостта на CAR Т клетките in vivo.
Синдром на освобождаване на цитокини
Най-честият проблем след лечение с CAR-T клетки е синдром на освобождаване на цитокини (CRS), състояние, при което имунната система се активира и освобождава увеличен брой възпалителни цитокини. Клиничната проява на този синдром прилича на сепсис с висока температура, умора, миалгия, гадене, изтичане на капиляри, тахикардия и други сърдечни дисфункции, чернодробна недостатъчност и бъбречно увреждане. CRS се среща при почти всички пациенти, лекувани с CAR-T клетъчна терапия; всъщност наличието на CRS е диагностичен маркер, който показва, че CAR-T клетките работят, както е предвидено да убият раковите клетки. Забележете обаче, че по-високата степен на тежест на CRS не корелира с повишен отговор на лечението, а по-висока тежест на заболяването.
Невротоксичност, свързана с имунни ефекторни клетки
Неврологичната токсичност също често се свързва с лечението на CAR-T клетки. Основният механизъм е слабо разбран и може или не може да бъде свързан с CRS. Клиничните прояви включват делириум, частична загуба на способността да говорят кохерентно, като същевременно все още имат способността да тълкуват езика (изразителна афазия), понижена бдителност (затрупване) и гърчове. По време на някои клинични изпитвания са настъпили смъртни случаи, причинени от невротоксичност. Основната причина за смърт от невротоксичност е мозъчният оток. В проучване, проведено от Juno Therapeutics, Inc., петима пациенти, включени в проучването, са починали в резултат на мозъчен оток. Двама от пациентите са лекувани само с циклофосфамид, а останалите трима са лекувани с комбинация от циклофосфамид и флударабин. В друго клинично изпитване, спонсорирано от Центъра за изследване на рака на Фред Хътчинсън, има един докладван случай на необратима и фатална неврологична токсичност 122 дни след приложението на CAR-T клетки.
.














Discussion about this post